Археи - еще один домен живых организмов, помимо бактерий и эукариот, представители которого примечательны тем, что могут жить в экстремальных условиях обитания – при очень высоких температурах, низких или высоких значениях pH и при высокой концентрации соли. По своей морфологии клетки архей похожи на бактериальные (у них нет ядра и мембранных органелл), но многие молекулярные компоненты (к примеру, белки, участвующие в процессе репликации ДНК) сильно отличаются от бактериальных и больше похожи на эукариотические. Сравнительно недавно была открыта обособленная группа архей – асгардархеи. У этих архей обнаружены гомологи многих эукариотических белков, и методы молекулярной филогении помещают эукариот внутрь ветви архей как группу, сестринскую асгардархеям. Совсем недавно были открыты асгардархеи, у которых есть гомолог актина, который, по всей видимости, позволяет этим археям поддерживать форму клеток. Подробнее об этом можете послушать в нашей видеолекции.
Однако у архей есть свои уникальные особенности, которые не встречаются у других живых организмов. Одной из таких особенностей является строение мембран.
Основу клеточных мембран живых организмов составляют фосфолипиды - молекулы глицерола, связанные с одним остатком фосфорной кислоты и двумя остатками жирных кислот. Фосфолипиды образуют бислой – двойной слой, в котором гидрофильные “головки” - остатки фосфорной кислоты - экспонированы наружу, а гидрофобные “хвосты” - внутрь. Фосфолипиды архей отличаются от фосфолипидов бактерий и эукариот. Первое отличие заключается в том, что асимметрический центр молекулы глицерола у архей находится в L-, а не D-конфигурации, и эти организмы используют совершенно разные ферменты для синтеза своих фосфолипидов. Также, в отличие от неразветвленных “хвостов” у бактерий и эукариот, фосфолипидные “хвосты” архей представляют собой разветвленные изопреноидные цепочки и присоединяются к молекуле глицерола с помощью простой эфирной связи, а не сложноэфирной, как это происходит у представителей двух других доменов. Также изопреноидные хвосты фосфолипидов архей могут образовывать пяти- или шестичленные кольца. Образование таких колец в липидах архей зависит от температуры, при которой растут клетки, и предполагается, что за счет формирования циклов в липидных «хвостах» клетки могут регулировать текучесть своих мембран.

У многих архей-экстремофилов, например у Methanocaldococcus jannaschii, липиды мембран дополнительно модифицируются путем образования углерод-углеродных связей между концами двух фосфолипидных хвостов. В результате мембрана таких архей представляет собой не бислой, а монослой, состоящий из макроциклических глицерол-диалкил-глицерол-тетраэфиров (GDGT). Предполагается, что такое строение мембраны обеспечивает археям устойчивость к эстремальным условиям среды. У архей порядка Sulfolobales, которых мы исследуем в нашей лаборатории, мембраны также состоят из макроциклических тетраэфиров.
Такие липиды очень стабильны и хорошо сохраняются в осадочных породах, откуда их можно извлечь экстракцией органическими растворителями. Состав этих липидов (в частности, количества кольцевых групп) зависит от температуры, при которой жили клетки, и это позволяет палеоэкологам реконструировать условия среды, в которых обитали организмы в определенный период исторического развития (Kim et al., 2008).
Необычные макроциклические липиды архей были открыты в 1984 году – почти сорок лет назад (Comita et al., 1984), но механизм их биосинтеза все это время оставался неизвестным. То, каким образом образуются сшивки между терминальными углеродами липидных хвостов, долгое время оставалось загадкой для ученых. Такая реакция могла протекать двумя путями: “ненасыщенный” путь предполагал, что сшивки между липидными хвостами образуются на том этапе, когда изопреноидные хвосты еще содержат двойные связи. Противоположная теория “насыщенного” пути заключалась в том, что сшивки образуются уже между насыщенными алкильными хвостами. Этот путь, однако, требует активации двух инертных sp3-гибридизованных атомов углерода, что возможно только в процессе химической реакции с участием радикалов.
Большинство ферментов, осуществляющих радикальные реакции, для своей работы требует наличие кислорода, но это не согласуется с облигатно анаэробными условиями обитания множества архей (включая M. jannaschii), синтезирующих GDGT. В то же время существует группа ферментов (rSAM – radical SAM enzymes), катализирующих радикальные реакции с участием особой молекулы S-аденозилметионина (SAM). Эти ферменты расщепляют S-аденозилметионин до метионина и 5′-дезоксиаденозил-5′-радикала (5′-dA-) - мощного окислителя, инициирующего радикальную реакцию. Все эти ферменты расщепляют SAM в ходе реакции одноэлектронного восстановления, и для этого в их реакционных центрах есть особый кофактор – железосерный кластер.
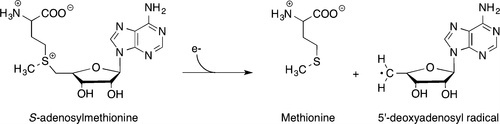
Фермент, осуществляющий сшивку двух изопреноидных липидных хвостов у архей, был открыт группой ученых из Университета штата Пенсильвания (Lloyd et al., 2022). В статье Lloyd et al., опубликованной в 2022 году в журнале Nature,был описан механизм работы этого белка, который назвали GDGT-макроциклической археол синтазой (GDGT-MAS).
Самое интересное в таких исследованиях – то, как ученые приходят к своим открытиям. Напомним вам, что механизм биосинтеза архейных макроциклических липидов оставался неизвестным в течение нескольких десятков лет. Как ученые решили выбрать один белок из тысяч других белков, закодированных в архейном геноме?
Открытие GDGT-MAS произошло случайно в процессе изучения ферментов суперсемейства rSAM. Научная группа исследовала механизм биосинтеза метаноптерина – одного из важных кофакторов, участвующих в образовании метана метаногенными археями. Они исследовали белок MJ0619, который предположительно мог катализировать присоединение метильной группы к предшественнику метаноптерина. Однако реакция in vitro, проводившаяся в присутствии MJ0619, S-аденозилметионина и птериноподобного субстрата, не привела к образованию какого-либо продукта. Чтобы понять, в чем же дело, ученые решили выяснить структуру этого белка.
Структура MJ0619, полученная с помощью рентгеноструктурного анализа, показала, что изначальное предположение о функции этого фермента было неверным. Активный центр MJ0619 не подходит для связывания такой большой гидрофильной молекулы как метаноптерин, зато хорошо подходит для связывания гидрофобного субстрата. Но вот что это за субстрат?
Для того, чтобы наработать препарат белка MJ0619 для анализа, ген этого белка экспрессировался в клетках E. coli – это стандартная практика для получения белков. После разрешения структуры выяснилось, что исследуемый белок выделился в комплексе с бактериальными липидами – в его активном центре были обнаружены 2 молекулы диацилглицерола, причем располагались они таким образом, что две гидрофильные головки были ориентированы на внешнюю сторону фермента, а каждый из алкильных хвостов располагался в своем гидрофобном кармане. Один из этих карманов содержал 5′-dA- и [Fe4S4]-кластер, что позволило предположить, что именно в нем и происходит радикальная реакция. Другой карман был выстлан гидрофобными аминокислотными остатками и своей структурой напоминал таковые у других липид-синтезирующих ферментов.

Получение структуры MJ0619 уже в присутствии 5′-dA- и метионина позволило установить, что алкильный хвост первого липида ориентируется в гидрофобный кармане, содержащем 5′-dA-, таким образом, что терминальный атом углерода алкильной группы располагается напротив 5′-dA-. С помощью 5′-dA- происходит активация этого атома углерода. Но на данном этапе возникает следующая проблема: чтобы осуществить сшивку двух алкильных хвостов, необходимо две молекулы S-аденозилметионина, в то время как активный центр MJ0619 содержит только одну. А следовательно, ферменту необходимо стабилизировать первый субстратный радикал во время генерации второго.
Первая гипотеза того, как осуществляется стабилизация, заключалась в том, что на начальном этапе от терминального атома углерода отщепляется один электрон и один атом водорода с образованием на конце алкильной цепи промежуточного продукта с двойной связью. Образующийся вслед за ним второй субстратный радикал атакует олефиновый интермедиат с образованием C-C связи. Такой сценарий предположительно должен был протекать при участии аминокислотного остатка Tyr459, который оказался консервативным при выравнивании с родственными белками. Однако замена Tyr459 на фенилаланин и лейцин не повлияла на работу фермента, и эта гипотеза была отвергнута.
Вторая возможная стратегия предполагала, что первый субстратный радикал соединяется с [Fe4S4]-кластером, располагающимся в реакционном центре напротив 5′-dA-, с помощью S-C связи. Потом второй субстратный радикал атакует атом углерода, связанный с [Fe4S4]-кластером, в результате чего и образуется связь C-C. Для проверки этой гипотезы провели реакцию in vitro при соотношении (фермент):(S-аденозилметионин) равном 1:1, а не 1:2, что приводило к накоплению в реакционной смеси интермедиата реакции. После разрушения FeS-кластеров кислотой, в реакционной смеси был обнаружен продукт S-GDGT, что согласовывалось с предположением, что интермедиатом реакции является алкильный радикал, связанный с [Fe4S4]-кластером.

Таким образом, в данной работе был идентифицирован фермент, ответственный за образование сшивок между терминальными атомами углерода алкильных хвостов липидов архей. Было установлено, что фермент GDGT-MAS, осуществляющий эту реакцию, использует продукт расщепления S-аденозилметионина 5′-dA- для активации sp3-гибридизованных атомов углерода, располагающихся на концах алкильных групп. После активации первого атома углерода, получившийся субстратный радикал присоединяется к [Fe4S4]-кластеру, который, как и S-аденозилметионин, находится в активном центре фермента. При атаке вторым субстратным радикалом первого в месте связывания с[Fe4S4]-кластером образуется C-C связь.
Также в 2022 году была опубликована статья (Zeng et al., 2022),в которой был охарактеризован фермент Tes - тетраэфирная синтаза, которая также участвует в биосинтезе GDGT.
Текст подготовила Наталья Кондратенко, редактор текста – Матвей Колесник.
Литература
Comita, P. B., Gagosian, R. B., Pang, H., & Costello, C. E. (1984). Structural elucidation of a unique macrocyclic membrane lipid from a new, extremely thermophilic, deep-sea hydrothermal vent archaebacterium, Methanococcus jannaschii. Journal of Biological Chemistry, 259(24), 15234–15241. https://doi.org/10.1016/S0021-9258(17)42540-3
Kim, J.-H., Schouten, S., Hopmans, E. C., Donner, B., & Sinninghe Damsté, J. S. (2008). Global sediment core-top calibration of the TEX86 paleothermometer in the ocean. Geochimica et Cosmochimica Acta, 72(4), 1154–1173. https://doi.org/10.1016/j.gca.2007.12.010
Lloyd, C. T., Iwig, D. F., Wang, B., Cossu, M., Metcalf, W. W., Boal, A. K., & Booker, S. J. (2022). Discovery, structure, and mechanism of a tetraether lipid synthase. Nature. https://doi.org/10.1038/s41586-022-05120-2
Zeng, Z., Chen, H., Yang, H., Chen, Y., Yang, W., Feng, X., Pei, H., & Welander, P. V. (2022). Identification of a protein responsible for the synthesis of archaeal membrane-spanning GDGT lipids. Nature Communications, 13(1), 1545. https://doi.org/10.1038/s41467-022-29264-x
Kim, J.-H., Schouten, S., Hopmans, E. C., Donner, B., & Sinninghe Damsté, J. S. (2008). Global sediment core-top calibration of the TEX86 paleothermometer in the ocean. Geochimica et Cosmochimica Acta, 72(4), 1154–1173. https://doi.org/10.1016/j.gca.2007.12.010
Lloyd, C. T., Iwig, D. F., Wang, B., Cossu, M., Metcalf, W. W., Boal, A. K., & Booker, S. J. (2022). Discovery, structure, and mechanism of a tetraether lipid synthase. Nature. https://doi.org/10.1038/s41586-022-05120-2
Zeng, Z., Chen, H., Yang, H., Chen, Y., Yang, W., Feng, X., Pei, H., & Welander, P. V. (2022). Identification of a protein responsible for the synthesis of archaeal membrane-spanning GDGT lipids. Nature Communications, 13(1), 1545. https://doi.org/10.1038/s41467-022-29264-x